
研究
生命活動を支える「分子機械」としてのタンパク質は、20種類のアミノ酸からなる高分子で、その種類は10万以上に及びます。それぞれが独自の役割を担い、高度で精密な連携を図りながら生命現象を構築しています。タンパク質は単なるアミノ酸の連鎖ではなく、種類や配列順に応じた特有の立体構造を持ち、その構造が環境の変化や他の分子との相互作用に応じて柔軟に変化し、生命システムを支える機能を発揮します。このような動的で精密な仕組みを解明することは、生命現象の本質を理解する上で不可欠です。当研究室では、生物物理学の視点から、これを一分子レベルで解明することを目指しています。一分子計測技術は、個々の分子の動きや相互作用をリアルタイムで直接観察できるため、従来の手法では見えなかった分子の詳細な挙動や機能発現のメカニズムを明らかにします。特に、原子間力顕微鏡(AFM)を中心とした計測技術の開発と応用に取り組み、一分子レベルで分子の動態や相互作用を多角的に解析し、生命システムの基盤となる分子機構の解明を目指しています。また、タンパク質だけでなく、人工的に設計された合成超分子や高分子ポリマーの動態解析にも取り組み、生命科学だけでなく材料科学やナノテクノロジー分野への応用も視野に入れています。さらに、人工分子とタンパク質を融合した「サイボーグ分子」を創成し、分子の機能向上や新規機能の創発に関する研究も進めています。このアプローチにより、自然には存在しない分子システムを設計・構築することで、生命現象や分子機能の理解を深めるだけでなく、医療や材料開発などの応用に繋がる新たな技術基盤を築いています。

セルロース分解酵素

F1-ATPase
AFM (原子間力顕微鏡)
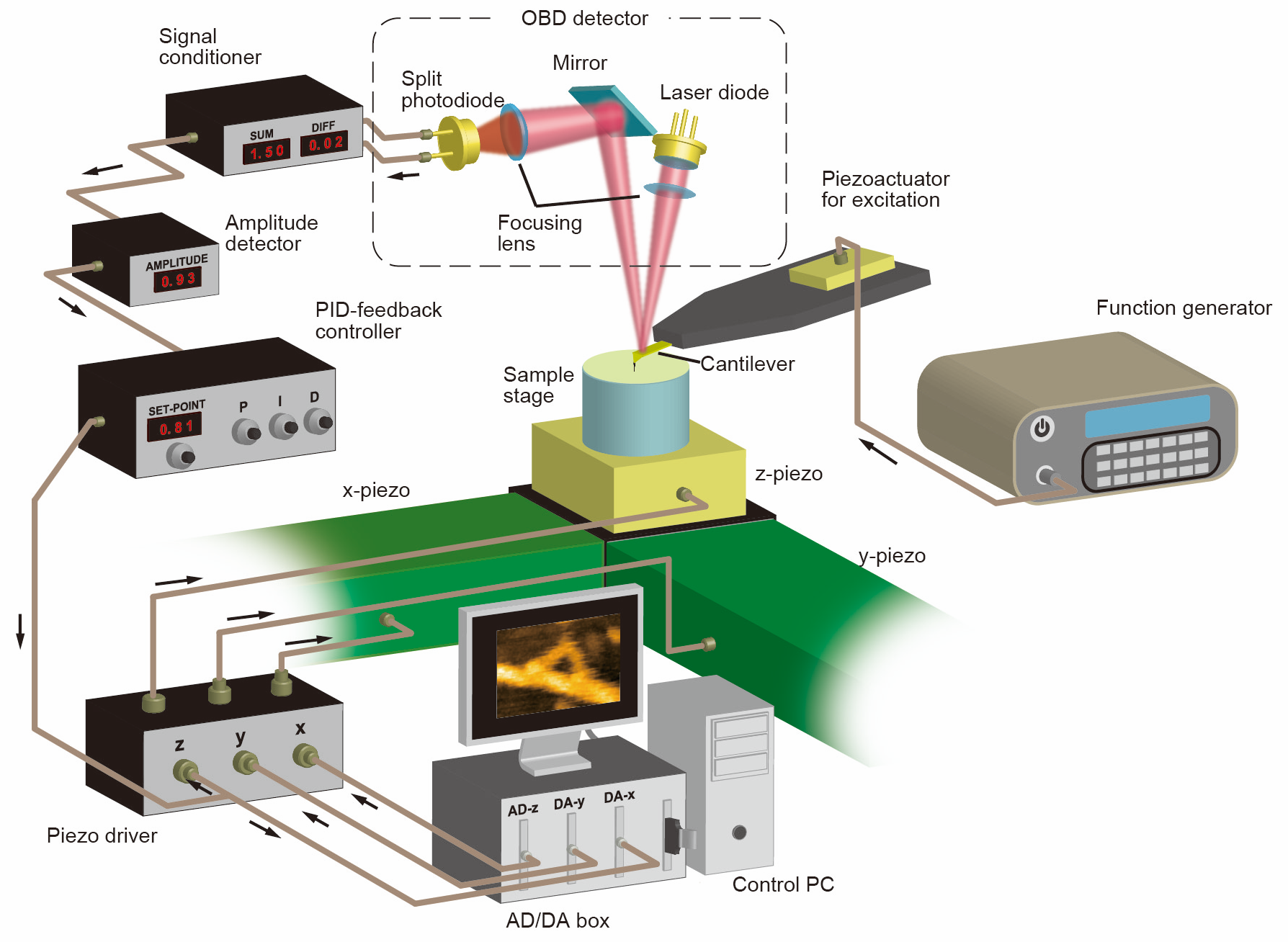
原子間力顕微鏡(Atomic Force Microscope: AFM)は, 1986年にG. Binning(IBMチューリッヒ)とC. Quate(スタンフォード大学)らによって発明されました[1]. G. Binningは1982年に走査型トンネル顕微鏡(Scanning Tunneling Microscope[2]を発明し1986年にはノーベル物理学賞を受賞していますが, STMではトンネル電流を計測するために導電性の試料しか観察できませんでした. AFMでは絶縁体試料でも高解像な試料表面構造の観察ができることから, 今ではナノサイエンスに欠かせない計測装置の一つになっています. AFM では柔らかい板バネ(カンチレバー)の先端に取り付けた先鋭な探針(プローブ)を試料表面に接触させ, プローブと試料との間に働く力学的相互作用をカンチレバーの変位によって検出します.プローブに作用する力を2次元マッピングすることで対象物の表面構造を画像化できます. 力としてクーロン力や磁気力を検出することで, 局所的な電気的情報をマッピングすることもできます. また, カンチレバーの振動を解析することで試料の局所機械特性を測ることもでき, 表面構造と同時に様々な物性情報を高解像に画像できます(STM, AFMから派生した多くの顕微鏡技術があり, 総称して走査型プローブ顕微鏡と呼ばれます). AFMの大きな特徴の一つは動作環境を選ばないことで, 真空・大気中はもちろん溶液中にある試料でも観察できます. そのため, 発明直後から溶液動作AFMの開発と生体試料観察への応用が精力的に行われ, 現在までに多種様々なタンパク質, 核酸, 染色体から細胞まで多岐にわたる試料の観察が報告されています[2]。一方で, AFMは1枚の画像を取得するのに、数十秒から数分の時間が必要なため, 分子の拡散や集合などの分子間相互作用や分子自体の構造変化など動きを伴う現象を観察することは困難でした。
1. G. Binnig, C. F. Quate, & Ch. Gerber, "Atomic Force Microscope", Phys. Rev. Lett. 56, 930–933 (1986).
2. G. Binnig, H. Rohrer, Ch. Gerber & E. Weibel, "Surface studies by Scanning Tunneling Microscopy", Phys. Rev. Lett. 49 57–61 (1982).
HS-AFM (高速原子間力顕微鏡)―タンパク質の動態を一分子レベルで解明する革新的アプローチ
タンパク質の大きさは通常10~50 nm(ナノメートル)程度で、通常の顕微鏡ではその構造や動態を直接観察することはできません。これまで光学顕微鏡やX線結晶構造解析などが用いられてきましたが、溶液中での動態観察には限界がありました。一方、AFMは「触覚」の原理を応用して、針と試料の間に働く微小な力を検出することで表面構造を画像化します。この特性により、AFMは溶液環境下で動作可能で、生きたタンパク質をナノスケールで観察できるという利点を持っています。しかし従来のAFMでは画像化速度が遅く、動的な分子挙動をリアルタイムで観察することは困難でした。当研究室では、AFMの高速化に取り組み、1枚の画像を100ミリ秒(ms)で取得できる「高速AFM」を開発しました。この技術により、タンパク質が溶液中で動く様子をリアルタイムで撮影でき、動的な分子機構の解明に大きく貢献しています。例えば、高速AFMを用いてアルツハイマー病の原因タンパク質であるアミロイドベータ(Aβ)の線維化過程を詳細に観察し、線維形成の初期過程や成長メカニズムを明らかにしました。また、線維形成を阻害する抗体との相互作用を観察することで、新たな治療法や創薬研究にも貢献しています。このように、高速AFMは基礎から応用まで幅広い分野に活用されています。
AFMの動作原理
アミロイド線維の伸長過程の観察
高速AFMの構成
アミロイド線維への抗体の結合
高速AFMの機能拡張―多角的解析を可能にする新技術の開発―
当研究室では、高速AFMの機能拡張を進め、生体分子の観察や解析の可能性をさらに広げています。例えば、蛍光顕微鏡や電気化学計測との複合化により、AFMでは得られない情報を補完する技術を開発しています。蛍光顕微鏡との複合化により、化学反応をリアルタイムで計測しながら、AFMでその反応に伴う構造変化を同時に観察することが可能になりました。また、電気化学計測との融合により、試料表面の電荷分布や電気的特性をマッピングでき、生体分子やナノ材料の電気的性質の理解が進んでいます。
さらに、分子を引っ張ったり押したりする力学的操作を行いながら、その応答をリアルタイムで観察する分子操作機能も開発しています。この技術により、タンパク質が力学的刺激にどのように応答し、構造変化や機能発現に至るのかを詳細に解析することが可能となりました。また、最近ではタンパク質や細胞の柔軟性や剛性をマッピングし、その時間変化を計測する新しい手法も確立しました。これにより、力学的観点から生体分子のメカニズムを探究する新たな道が開かれています。
このように、高速AFMは化学的・力学的・電気的情報を同時に取得できる多角的な解析ツールへと進化しており、生命科学や材料科学における研究の可能性を広げています。

